
2025年6月26日��,由江蘇美鳳力醫(yī)療科技有限公司主辦、蘇州工業(yè)園區(qū)生物產業(yè)發(fā)展有限公司協(xié)辦的"醫(yī)療器械上市及出海新路徑新資源分享會"在蘇州生物醫(yī)藥產業(yè)園圓滿舉行��。
作為美鳳力舉辦的第二場專題分享會�����,本次活動聚焦醫(yī)療器械行業(yè)發(fā)展的熱點議題����,匯聚了眾多行業(yè)專家、投資機構代表及企業(yè)領袖����,共同探討醫(yī)療器械企業(yè)國內外上市的新機遇、全球化布局的創(chuàng)新路徑以及資源整合的有效策略���,為行業(yè)高質量發(fā)展提供了新思路���。在當前醫(yī)療器械產業(yè)蓬勃發(fā)展的背景下,本次活動為企業(yè)把握市場機遇���、實現(xiàn)國際化發(fā)展搭建了專業(yè)的交流平臺����。

美鳳力集團董事長魏旭峰教授在開場致辭中指出�����,醫(yī)療器械企業(yè)在上市準入等后端環(huán)節(jié)面臨重大挑戰(zhàn)����,美鳳力依托全球資源網絡和OECD、FDA GLP雙認證資質����,已從動物實驗專家轉型為全產業(yè)鏈服務平臺,致力于助力中國醫(yī)療器械成功出海����。蘇州工業(yè)園區(qū)生物產業(yè)發(fā)展有限公司商務拓展部孫鍇經理表示,作為國內領先的生物醫(yī)藥園區(qū)����,BioBAY此次與美鳳力合作舉辦分享會,旨在幫助園區(qū)企業(yè)把握全球化機遇�����,解決產品出海實際難題,推動優(yōu)質醫(yī)療器械走向國際市場����。

針對創(chuàng)新醫(yī)療器械出海面臨的歐美市場挑戰(zhàn)——包括龐大患者群體�、寡頭壟斷格局、嚴苛的研發(fā)評價標準以及復雜政策環(huán)境等難題���,美鳳力打造了創(chuàng)新醫(yī)療器械出海整體化解決路徑:通過獲取國際權威認證����、建立全球合作伙伴網絡�、構建專業(yè)化海外運營架構等系統(tǒng)性舉措,為產品出海鋪平道路�。同時,公司充分發(fā)揮在實驗設施���、專業(yè)團隊和服務體系等方面的綜合優(yōu)勢����,為不同發(fā)展階段的企業(yè)提供定制化解決方案�����,助力創(chuàng)新醫(yī)療器械實現(xiàn)全球化布局。

02����、港澳及東南亞產品上市新資源分享—鄧南天全球器械市場概況�,如2024年中國醫(yī)療器械出口情況及主要地區(qū)注冊數(shù)量;香港準入法規(guī)��,包括醫(yī)療器械分類����、注冊路徑及 “港澳藥械通” 政策;香港政府資助計劃����,像企業(yè)支援計劃、生物醫(yī)藥科技培育計劃等���;東南亞準入法規(guī)����,以東盟《東盟醫(yī)療器械指令》為框架��,介紹越南��、馬來西亞等國的注冊要求;最后介紹天之恒醫(yī)療的服務�、團隊、優(yōu)勢���、成功案例及合作伙伴等���。

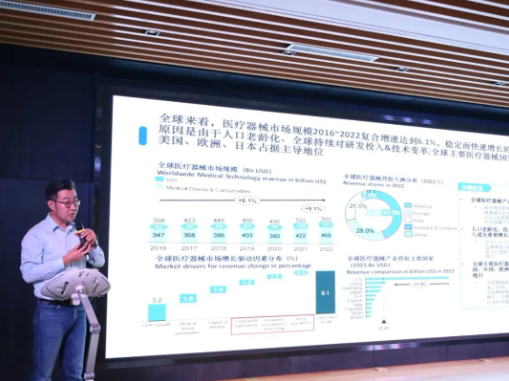
03、創(chuàng)新器械海外臨床試驗新資源分享—鄧曉宇2016 - 2022 年全球醫(yī)療器械市場復合增速 6.1%�,美國、歐盟���、日本占主導�����,美國市場規(guī)模超 2000 億美元且關注微創(chuàng)技術����,歐盟市場與中國相當且數(shù)字健康方案受歡迎��,“一帶一路” 國家中東盟十國是主要出口市場�。針對中國企業(yè)出海 “散點失焦” 現(xiàn)狀,提出 Rede 一站式解決方案,涵蓋臨床�、注冊到商業(yè)化落地全流程,以中國為中心管理全球資源��,可節(jié)約時間����、降低成本���。希毅醫(yī)學已與美����、西歐����、東歐眾多頂尖醫(yī)院合作,如麻省總醫(yī)院�����、杜塞爾多夫大學醫(yī)院等���,還通過 PMCF 幫助企業(yè)在歐洲市場實現(xiàn)銷量大幅增長��。
04�、中美貿易戰(zhàn)下,醫(yī)療器械輸美的機遇和挑戰(zhàn)—Tracy Teng聚焦中美關稅戰(zhàn)背景下�����,醫(yī)療器械出口美國面臨的機遇與合規(guī)挑戰(zhàn)���。關稅方面����,2025 年日內瓦會談后關稅有所調整�,同時行業(yè)關稅針對特定關鍵行業(yè)且不豁免。FDA 監(jiān)管上�����,新任局長推動審批流程優(yōu)化等改革����,醫(yī)療器械監(jiān)管分三類,合規(guī)需過注冊�、出口、上市三關����,常見誤區(qū)包括誤認 FDA 需驗廠����、產品需送檢等���,扣貨原因涉及列名缺失���、注冊錯誤等。上市后還面臨稽查����、不良事件報告等要求���,且 FDA 出臺突擊檢查新規(guī)��。 Registrar Corp 的 Buyer Finder 智能服務����、專家團隊及服務案例��,為企業(yè)提供合規(guī)支持���。

05��、歐盟認證常見問題解析及快速認證路徑分享—張惠一方面���,全球MDR 認證匯總顯示����,截至 2024 年 10 月 31 日�����,50 家指定認證機構收到 28512 份 MDR 申請�,17729 份簽協(xié)議,拒絕 421 份��,還呈現(xiàn)了 QMS 和產品認證���、特定器械認證情況及認證時間周期等數(shù)據(jù)��。另一方面�����,UDEM 認證優(yōu)勢及特點突出�,審核資質較全、經驗豐富�,有審核不排隊、閉口合同等六大優(yōu)勢�,不同產品等級認證周期不同,還展示了證書樣例及數(shù)據(jù)庫查詢情況��。

06�、新生態(tài)助力創(chuàng)新器械快速掛網及入院—李孝朋醫(yī)保掛網準入現(xiàn)狀中的痛點難點,如掛網難��、成本高����、信息復雜等,強調其是國家管控醫(yī)療耗材的重要手段���,企業(yè)需提前謀劃且注重時效性。接著介紹省級陽光掛網�、區(qū)域聯(lián)盟采購等六大主要模式及從準入前準備到掛網后管理的業(yè)務流程。然后介紹匯智醫(yī)創(chuàng)作為美鳳力集團戰(zhàn)略合作伙伴�����,具備專業(yè)團隊����、豐富產業(yè)資源及全國 27 省醫(yī)保平臺數(shù)據(jù)庫等能力�,可提供醫(yī)保掛網戰(zhàn)略咨詢��、數(shù)據(jù)賦能��、創(chuàng)新成果轉化及市場銷售等服務�����,助力創(chuàng)新醫(yī)療器械發(fā)展�����。

與會嘉賓圍繞中國企業(yè)國際化發(fā)展展開討論���。嘉賓指出�����,美國市場公平開放且青睞創(chuàng)新產品��,建議中國企業(yè)重點提升產品安全性�����、臨床試驗多樣性及用戶體驗設計���,并對中國企業(yè)出海充滿信心�����。長三角國創(chuàng)中心作為全國三大綜合性科技創(chuàng)新平臺之一�����,聚焦生物醫(yī)藥領域����,通過投資孵化與資源對接助力初創(chuàng)企業(yè)拓展國際市場���。針對創(chuàng)新醫(yī)療器械企業(yè)面臨的掛網難題,美鳳力整合產業(yè)鏈資源��,幫助企業(yè)加速產品上市與資金回籠�����。此外,園區(qū)代表介紹了支持生物醫(yī)藥企業(yè)出海的配套服務���,包括研發(fā)中心及POC驗證平臺等核心資源�����,為企業(yè)全球化布局提供有力支撐�。

作為行業(yè)資源整合者���,美鳳力期待與更多合作伙伴攜手���,打通從研發(fā)、認證到市場落地的全鏈條服務���,助力中國醫(yī)療器械企業(yè)突破國際合規(guī)壁壘�����、加速全球化布局���。依托長三角國創(chuàng)中心等戰(zhàn)略合作平臺�����,美鳳力將進一步深化臨床研究��、注冊申報�����、市場準入等核心能力建設��,為創(chuàng)新產品提供“一站式”出海解決方案��。未來�����,美鳳力將將持續(xù)深化平臺服務功能����,以專業(yè)服務為支點�,推動中國醫(yī)療器械高質量走向世界舞臺,讓更多創(chuàng)新成果惠及全球患者����。
美鳳力借多年的大動物經驗,堅持以“務實求真”為宗旨����,累計為4000多家客戶提供品質大動物臨床前服務,得到了客戶的一致好評����。如果您有動物試驗、臨床培訓����、組織病理、大動物試驗��、臨床試驗�����、產品注冊科研課題等...
請立即點擊咨詢我們或撥打咨詢熱線: 17312606166 ���,我們會詳細為你一一解答你心中的疑難�。 添加好友




 17312606166
17312606166