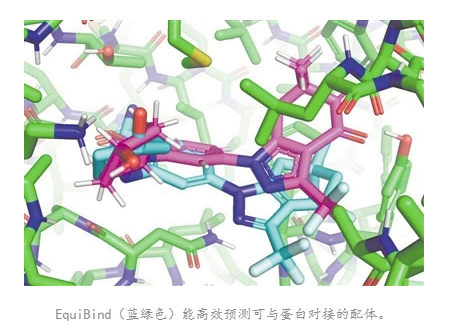
據(jù)美國麻省理工學院(MIT)官網(wǎng)月7月12日報道�,該校科學家開發(fā)出一款名為EquiBind的幾何深度學習模型���,其將類藥物分子與蛋白配對的效率比現(xiàn)有最快的計算分子配對模型QuickVina2-W快1200倍���。相關研究已經(jīng)提交預印本服務器���,并將提交給國際機器學習大會。
在藥物開發(fā)之前�����,研究人員必須找到有潛力的類藥物分子,這些分子可以與某些蛋白質靶點正確結合或“對接”——這一過程被稱為藥物發(fā)現(xiàn)�。類藥物分子(配體)成功與蛋白質對接后,可以阻止蛋白質發(fā)揮功能�����。如果蛋白質是細菌的一種必需蛋白質���,配體就可以殺死細菌��,從而保護人體��。
目前尋找潛在藥物候選分子的計算過程大致如下:大多數(shù)最先進的計算模型依賴繁重的候選采樣�����,以及評分����、排序和微調等方法����,從而讓配體和蛋白質之間實現(xiàn)最佳“匹配”。
最新研究主要作者、美國麻省理工學院電氣工程和計算機科學系研究生漢尼斯·斯塔克表示�����,上述傳統(tǒng)的配體—蛋白質結合方法就像“嘗試將鑰匙插入有許多鎖孔的鎖中”�。這種方法需要花費大量時間對每個“鎖孔”進行嘗試,才能找到最佳匹配��。相反��,EquiBind僅需一個步驟就可以直接精準預測配體與蛋白質配對的精確位置�,這是因為其擁有內(nèi)置的幾何推理能力����,可以幫助模型了解并學習分子的基本情況,在遇到新的數(shù)據(jù)時能夠進行概括����,以做出更好的預測。
該研究引起了專業(yè)人士的興趣����。接力醫(yī)療公司首席數(shù)據(jù)官帕特·沃爾特斯建議其團隊在現(xiàn)有的一種用于肺癌、白血病和胃腸道腫瘤的藥物和蛋白質上嘗試這一最新模型�����,結果EquiBind取得了成功,而大多數(shù)傳統(tǒng)的配對方法無法讓蛋白和配體成功配對��。
沃爾特斯說�����,EquiBind為配對問題提供了一種獨特的解決方案����,它結合了姿態(tài)估計和結合位點識別。這種方法利用了數(shù)千種公開可用的晶體結構的信息�����,可能對藥物開發(fā)領域產(chǎn)生新的影響�����。




 17312606166
17312606166